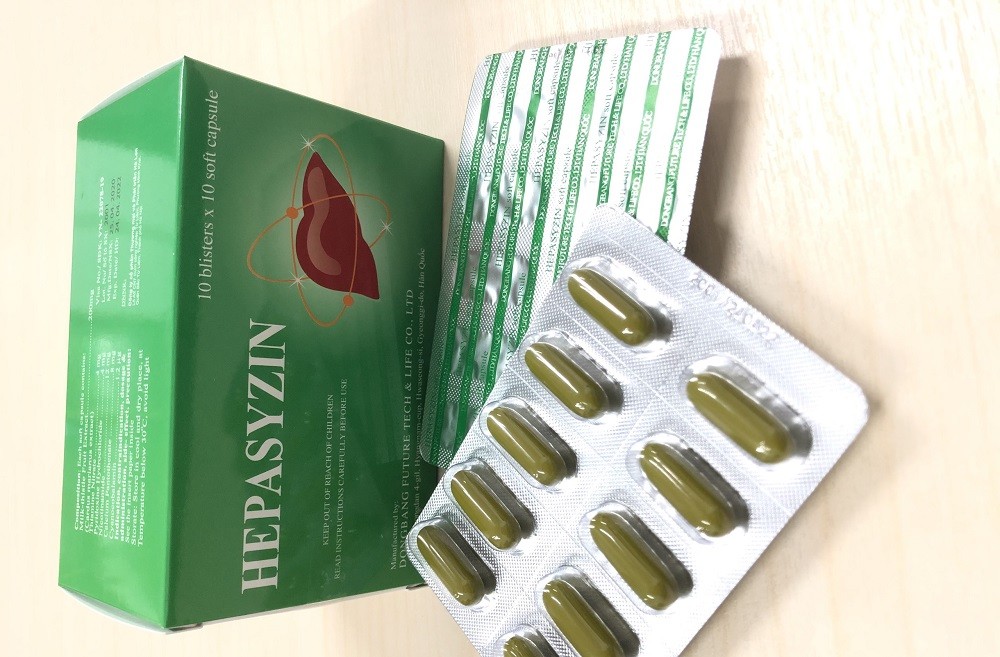
Theo nội dung Công văn của Sở Y tế Hà Nội, thực hiện Công văn số 10344/QLD-CL ngày 14/10/2022 của Cục Quản lý Dược về việc mẫu thuốc Hepasyzin không đạt tiêu chuẩn chất lượng. Sở Y tế thông báo thu hồi trên địa bàn Hà Nội thuốc viên nang mềm Hepasyzin do không đạt yêu cầu chất lượng về chỉ tiêu Định lượng (vi phạm mức độ 2).
Các sản phẩm thuốc Hepasyzin nằm trong diện thu hồi có số GĐKLH: VN-22078-19, số lô: 2114, NSX: 14/04/2021, HD: 14/04/2024.
Sản phẩm do Công ty DongBang Future Tech & Life Co., Ltd. (Hàn Quốc) sản xuất, Công ty CP Thương mại và phát triển Hà Lan nhập khẩu.
Nội dung công văn cũng nêu rõ, Sở Y tế Hà Nội yêu cầu Giám đốc Công ty CP Thương mại và phát triển Hà Lan, Bệnh viện Đa khoa Quốc tế Bắc Hà thu hồi triệt để lô thuốc không đạt tiêu chuẩn chất lượng nêu trên trên địa bàn Hà Nội.
Sở Y tế sẽ kiểm tra, giám sát việc thu hồi thuốc viên nang mềm Hepasyzin, số GĐKLH: VN-22078-19, số lô: 2114, NSX: 14/04/2021, HD: 14/04/2024 của các đơn vị và việc gửi mẫu bổ sung để kiểm tra chất lượng của công ty CP Thương mại và phát triển Hà Lan.
Các cơ sở y tế công lập trực thuộc ngành, cơ sở y tế ngoài công lập, DN kinh doanh thuốc, cơ sở bán lẻ thuốc trên địa bàn khẩn trương rà soát, thu hồi lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
Phòng Y tế quận, huyện, thị xã thông báo đến cơ sở hành nghề trên địa bàn quản lý; tiến hành kiểm tra, giám sát việc thực hiện thu hồi của cơ sở (nếu có).
Trung tâm Kiềm soát bệnh tật Hà Nội đăng thông tin và phối hợp với các cơ quan truyền thông, thông tin tới cơ sở kinh doanh, sử dụng thuốc và người dân biết để không buôn bán, sử dụng.
Được biết, thuốc Hepasyzin có tác dụng điều trị viêm gan mạn tính, xơ gan, gan nhiễm mỡ, nhiễm độc gan (như: gan nhiễm mỡ, ngộ độc carbon tetraclorid…).
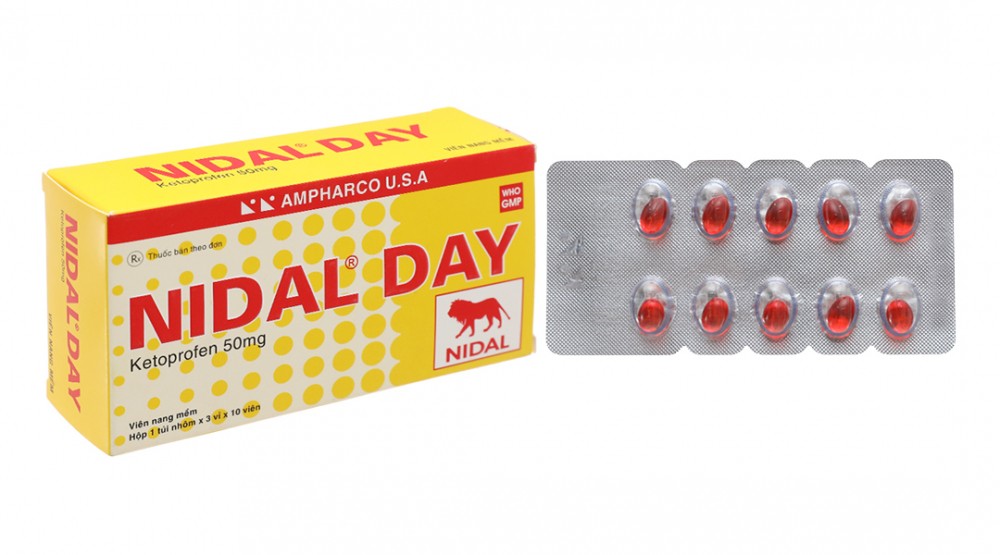
Trước đó, Sở Y tế Hà Nội cũng đã ban hành Công văn số 4501/SYT-NVD về việc thu hồi thuốc Nidal Day do Công ty CP Dược phẩm Ampharco U.S.A sản xuất.
Cụ thể, ngày 7/10/2022 Cục Quản lý Dược ra công văn số 10118/QLD-CL thông báp về việc mẫu thuốc Nidal Day không đạt tiêu chuẩn chất lượng.
Ngay sau khi tiếp nhận công văn, Sở Y tế Hà Nội đã ra thông báo thu hồi trên địa bàn Hà Nội thuốc viên nang mềm Nidal Day (Ketoprofen 50mg), SDK: VD- 25137-16, Lô SX: E1001, NSX: 19/05/2021, HD: 19/05/2024. Sản phẩm này do công ty CP Dược phẩm Ampharco U.S.A có nhà máy đặt tại KCN Nhơn Trạch 3, Đồng Nai sản xuất do không đạt yêu cầu chất lượng về chỉ tiêu Độ hòa tan (vi phạm mức độ 2).
Sở Y tế Hà Nội yêu cầu Giám đốc công ty CP Dadison Hoa Kỳ thực hiện thu hồi triệt để lô thuốc không đạt tiêu chuẩn chất lượng nêu trên, gửi báo cáo thu hồi, hồ sơ thu hồi theo quy định.
Sở Y tế Hà Nội thực hiện việc kiểm tra, giám sát thu hồi và yêu cầu các cơ sở y tế công lập, ngoài công lập, doanh nghiệp kinh doanh thuốc, cơ sở bán lẻ thuốc khẩn trương thực hiện theo yêu cầu.
Được biết, mẫu thuốc nói trên do Viện kiểm nghiệm thuốc Trung ương lấy tại công ty CP Dadison Hoa Kỳ có địa chỉ tại quầy 431, tầng 4, Hapu Medicenter, số 1 đường Nguyễn Huy Tưởng, quận Thanh Xuân, TP. Hà Nội.